Études scientifiques sur le Safran
Les études cliniques sur l’extrait Safr’Inside™
Contrairement à de nombreux extraits de safran disponibles sur le marché, Safr’Inside™, l'extrait de safran contenu dans nos gummies a fait l’objet d’études précliniques et cliniques décrivant ses spécificités et les mécanismes explorés. Sept travaux majeurs réalisés par Activ’Inside sont synthétisés ci-dessous, avec un accès direct aux publications. Cette page propose un résumé pédagogique des données disponibles et un panorama de la littérature sur le safran en général (humeur, sommeil, stress), dans une approche neutre et informative.

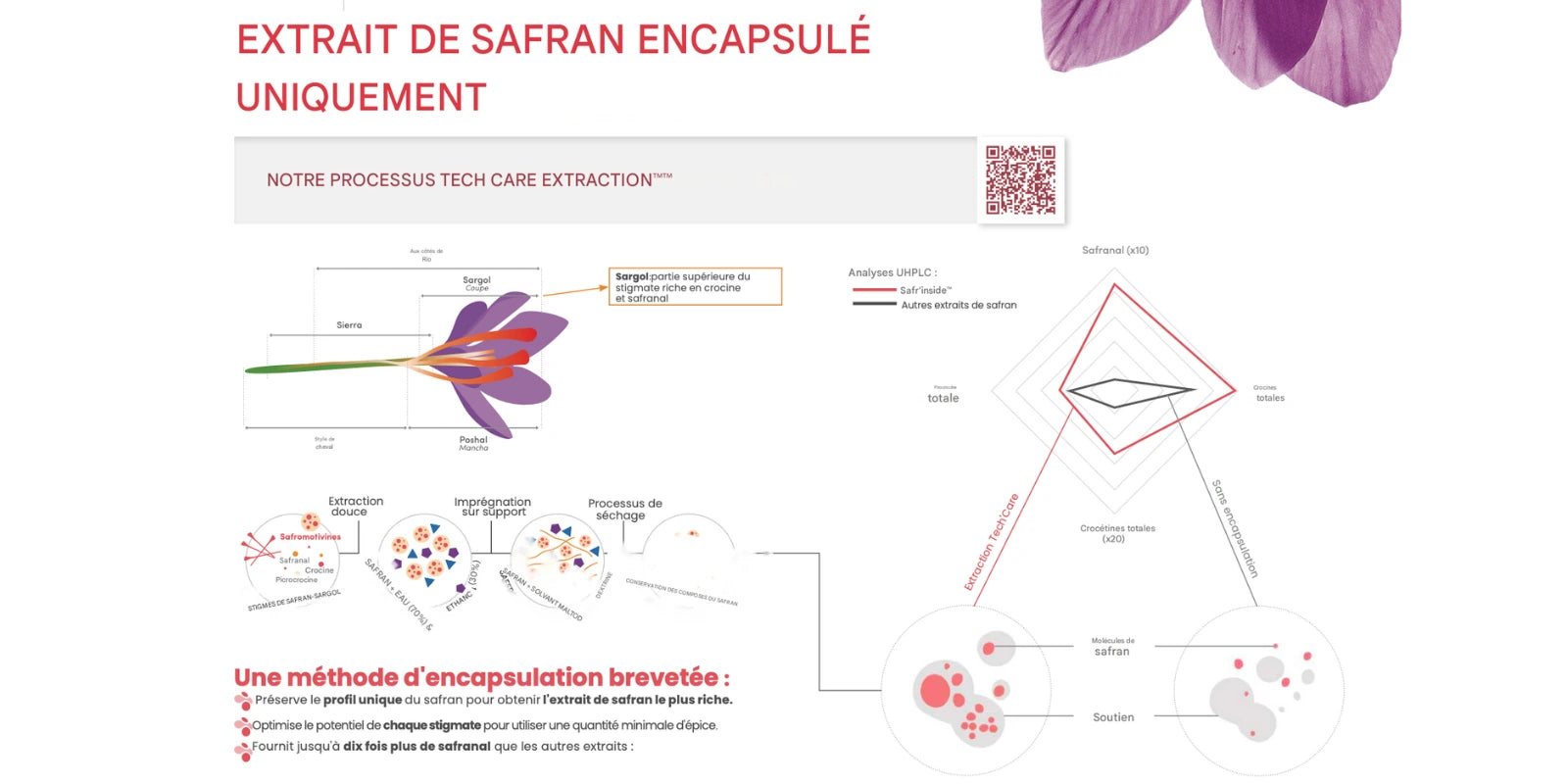
Un safran Sargol d’exception et une traçabilité totale
L'extrait de safran Safr’Inside™ est issu de la partie supérieure (Sargol) du stigma de Crocus sativus L., cultivée à Seno (Khorasan, Iran). Cette zone bénéficie d’un système d’irrigation traditionnel (Ghasabeh QANAT, env. 2 500 ans), favorable à une culture exigeante. La partie Sargol est reconnue pour sa concentration en marqueurs d’intérêt (crocine, picrocine, safranal, etc.).
Contrôles multiples : pour attester l’authenticité de l’extrait, dix tests sont réalisés (analyse ADN, vérification d’absence de safranal synthétique et de colorants, etc.).
Origine et standardisation : le safran est importé puis standardisé et concentré selon un procédé propriétaire, afin d’assurer la constance des marqueurs analytiques suivis.
Du safran 7× plus d’actifs
Grâce à la méthode d’extraction Tech’Care extraction™

7 études ayant identifié six mécanismes d’action adaptogènes
Le terme « adaptogène » est utilisé pour décrire des substances étudiées pour leur rôle potentiel d’aide face aux facteurs de stress (physique, émotionnel, environnemental). Pour Safr’Inside™, 7 études (ex vivo, in vivo et cliniques) décrivent six axes mécanistiques résumés ci-après.
1. Transmission sérotoninergique : observations ex vivo décrivant une protection de la neurotransmission (libération de sérotonine et de dopamine).
2. Réponse au cortisol : en situation de stress aigu, un décalage temporel de la montée du cortisol a été rapporté avec Safr’Inside™ selon le protocole étudié.
3. Inflammation systémique : essais ex vivo indiquant une modulation de cytokines pro-inflammatoires dans des modèles de stress prolongé.
4. Stress oxydatif neuronal : rôle de composés du safran (crocin, safranal) discuté en lien avec le BDNF (plasticité neuronale).
5. Variabilité de la fréquence cardiaque (HRV) : en clinique, maintien d’un équilibre sympathique/parasympathique plus favorable en contexte de stress.
6. Microbiote : en in vivo, soutien de bactéries d’intérêt (ex. Akkermansia) et effets décrits sur l’axe intestin-cerveau.
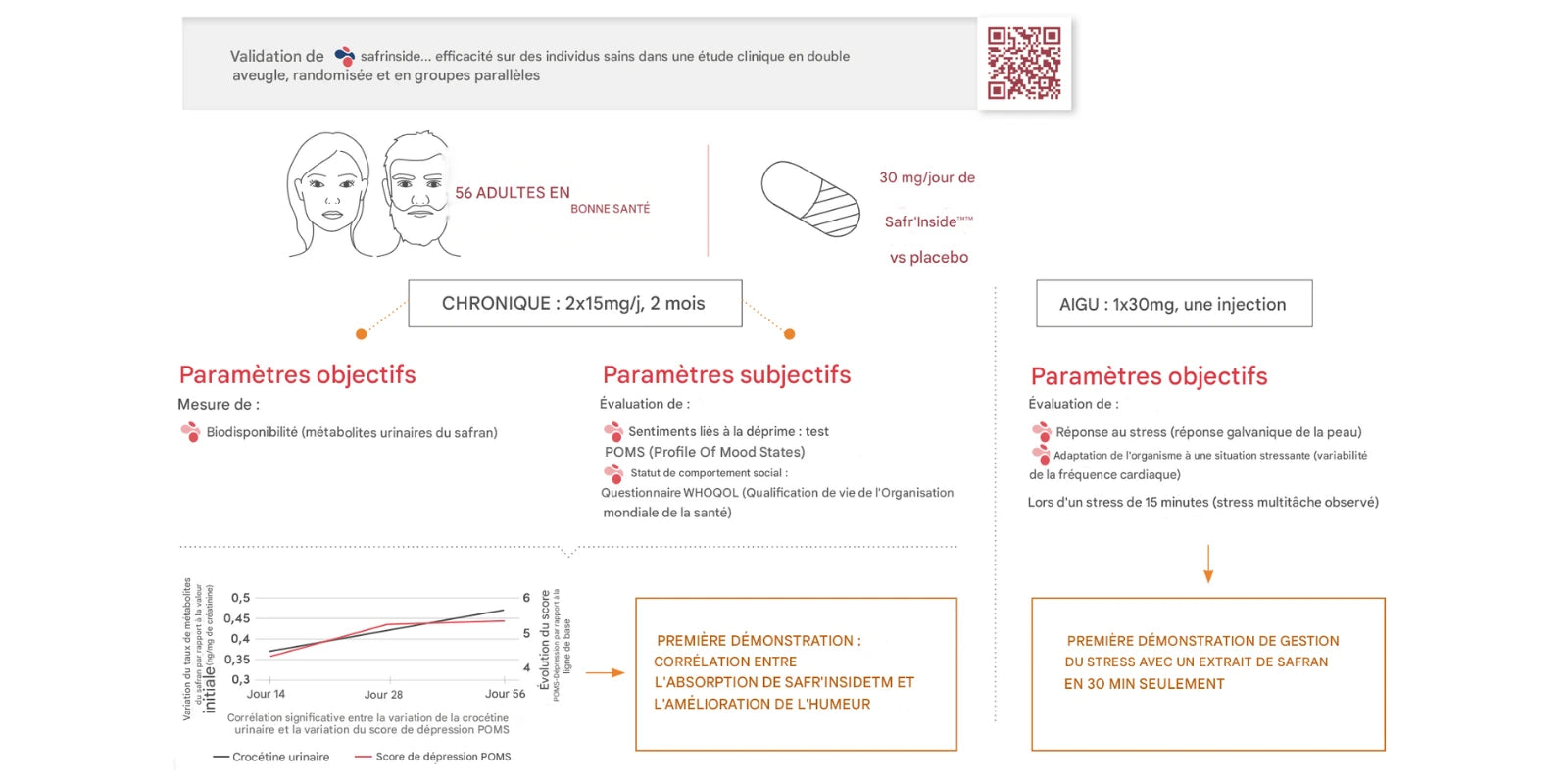
Essai clinique sur 56 jours (double aveugle, randomisé, contrôlé)
Étude menée chez 56 adultes en bonne santé présentant un état de « low mood ». Objectif : observer l’évolution de paramètres d’humeur et de qualité de vie sous Safr’Inside™ (30 mg/jour en 2 prises) pendant 56 jours, versus placebo.
Déroulement :
• Population : 56 volontaires, randomisés (Safr’Inside™ vs placebo).
• Durée : 8 semaines.
Outils :
• POMS-2 (sous-échelles dont « dépression », anxiété, tension).
• WHOQOL (relations sociales).
• Dosage urinaire de crocétine (biodisponibilité).
Principaux résultats rapportés
POMS-2 (sous-échelle « dépression ») : différences statistiquement significatives par rapport au placebo selon l’analyse publiée.
WHOQOL : interactions sociales perçues comme plus positives dans le groupe Safr’Inside™.
Biodisponibilité : hausse des taux urinaires de crocétine dès J14, avec corrélation rapportée à l’évolution du score « dépression ».
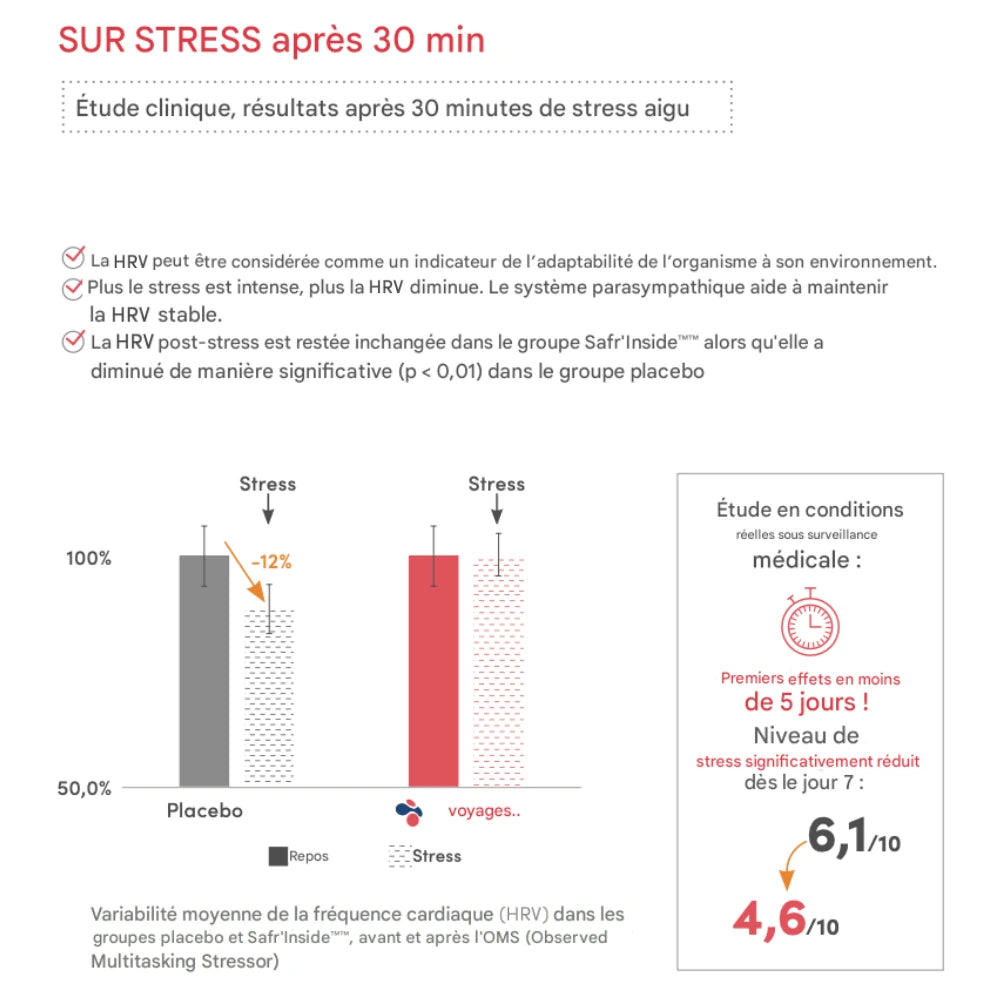
Protocole en prise unique : réponse au stress
Dans le même essai, un protocole a évalué la prise de Safr’Inside™ 30 minutes avant un test de stress avec mesure de la variabilité de la fréquence cardiaque (HRV).
Observations décrites :
- HRV plus élevée dans le groupe Safr’Inside™, traduisant un meilleur équilibre sympathique/parasympathique.
- Tension perçue : gestion du stress en temps réel jugée plus favorable selon les mesures retenues.
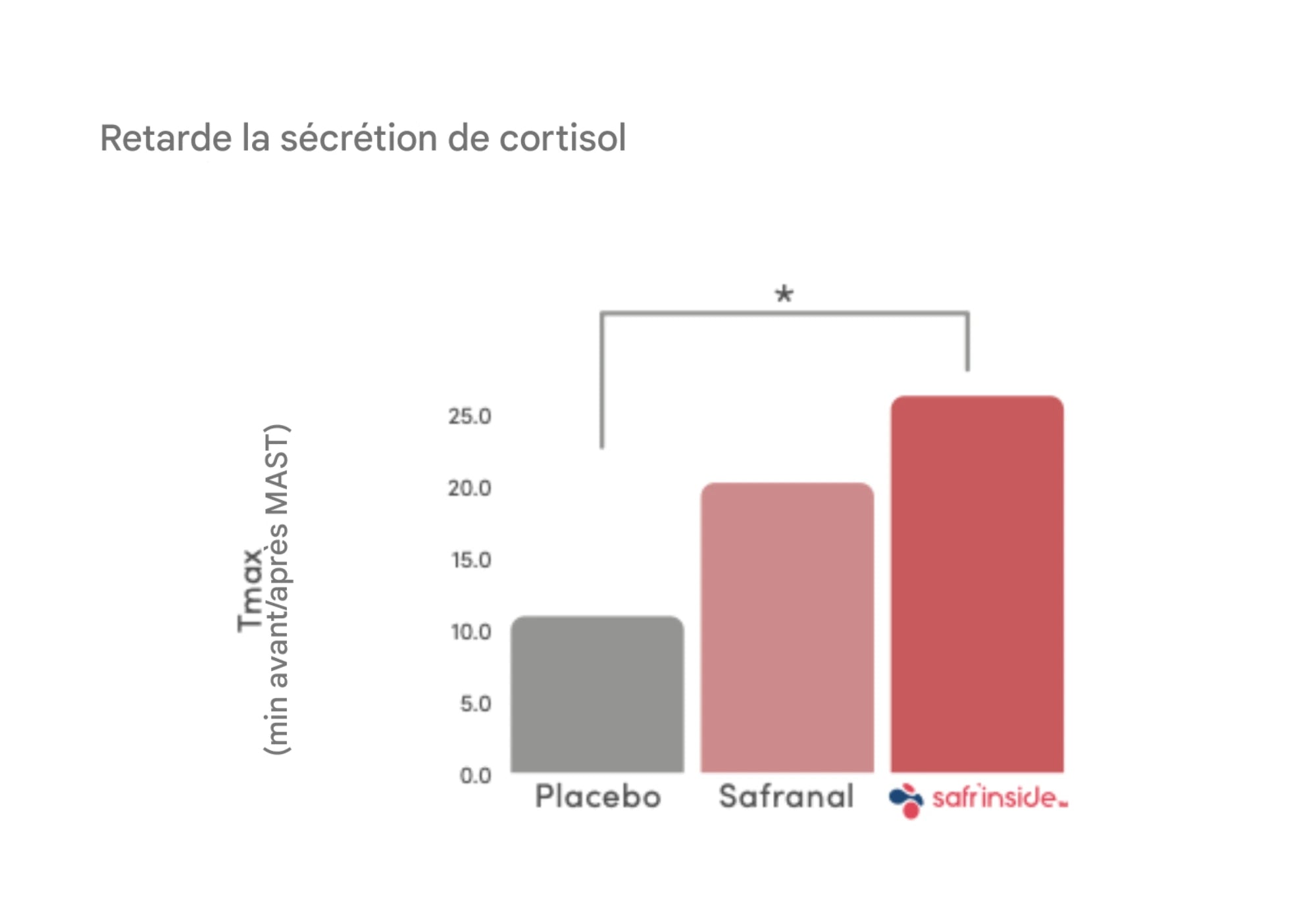
Réponse au cortisol : importance de la synergie
Des analyses ont comparé Safr’Inside™ (extrait complet, celui de nos gummies) et son composé volatil principal (safranal) administré isolément. Si le safranal montre un effet mesurable, les résultats sont plus marqués avec l’extrait complet, ce qui souligne la synergie entre crocine, picrocine, safranal et micronutriments du safran.
En pratique (protocole de stress aigu) :
- Mesure du cortisol pendant le test.
- Montée du cortisol retardée avec Safr’Inside™, décrite comme une meilleure résilience au stress dans ce cadre méthodologique.
Les études cliniques sur le safran en général
Le safran (Crocus sativus L.) est largement étudié. Les travaux présentés ci-dessous synthétisent des données cliniques portant sur des scores de dépression, d’anxiété et de qualité du sommeil, ainsi que sur l’humeur et le bien-être. Les intitulés restent descriptifs et les liens sources figurent en fin de page.

Les études cliniques sur le safran en général
Amélioration du bien-être et de l’humeur (Jackson et al., 2021)
Essai randomisé, en double aveugle, contrôlé par placebo (adultes sains avec baisse de moral/anxiété/stress subcliniques). Supplémentation : 30 mg d’extrait de safran pendant 8 semaines. Les auteurs rapportent une évolution favorable du bien-être émotionnel et des relations sociales, avec des différences observées sur des scores de dépression selon les échelles utilisées.
Comment l’étude a été menée :
- Répartition aléatoire entre groupe safran et groupe placebo.
- Mesures avant, pendant et après l’intervention via questionnaires validés (dépression, anxiété, stress).
- Différences statistiquement significatives entre groupes, avec baisse plus marquée de scores dépressifs dans le groupe safran.
Résultats rapportés
- Différences observées sur des scores de dépression et d’anxiété.
- Évolution positive du bien-être émotionnel et des relations sociales.

Données sur l’humeur et l’anxiété (Shafiee et al., 2018)
Travail portant sur des paramètres liés à l’humeur et à l’anxiété, comparés à des références pharmacologiques dans le modèle étudié. Les auteurs discutent notamment de la crocine et du safranal, ainsi que du profil de tolérance.
Comment l’étude a été menée :
- Modèle expérimental (dépression post-partum chez la souris) avec analyses biochimiques de la voie CREB-BDNF.
- Mesures comportementales selon des tests standardisés.
Résultats rapportés
- Réduction de comportements dépressifs et anxieux dans le modèle étudié.
- Régulation de la voie CREB-BDNF (plasticité neuronale).

Données sur des scores de dépression et d’anxiété (Ghaderi et al., 2020)
Méga-analyse d’essais cliniques randomisés : les auteurs rapportent des différences statistiquement significatives sur le Beck Depression Inventory (BDI) et le Beck Anxiety Inventory (BAI), ainsi qu’une amélioration du Pittsburgh Sleep Quality Index (PSQI). Les niveaux de CRP n’ont pas varié de façon notable.
Comment l’étude a été menée :
• Sélection d’études répondant à des critères méthodologiques définis.
• Analyse statistique intégrée (méta-analyse) pour estimer l’effet global sur dépression, anxiété et qualité du sommeil.
Résultats rapportés
- Différences statistiquement significatives observées sur des scores de dépression et d’anxiété.
- Amélioration de la qualité du sommeil.
- Pas d’impact notable sur la CRP.

Données rapportées dans des cas de dépression majeure (Marx et al., 2019)
Études menées chez des personnes présentant un trouble dépressif majeur. Des différences sur des échelles de symptômes sont rapportées entre l’extrait de safran et le placebo, selon les protocoles publiés.
Comment l’étude a été menée :
- Essais cliniques randomisés chez des participants avec trouble dépressif majeur.
- Évaluations régulières via échelles validées.
Résultats rapportés
- Baisse des scores de dépression rapportée dans le groupe safran, dans le cadre des mesures et du protocole publiés.

Amélioration de la qualité du sommeil (Lopresti et al., 2021)
Chez des adultes, les auteurs rapportent une amélioration de paramètres liés au sommeil (facilité d’endormissement, agitation nocturne, repos au réveil) après supplémentation en safran, sur la base d’outils d’évaluation dédiés.
Comment l’étude a été menée :
- Essai contrôlé, en double aveugle et randomisé.
- Mesures par questionnaires et, selon les protocoles, outils spécifiques (actimétrie, journal du sommeil).
Résultats :
- Amélioration statistiquement significative de la qualité du sommeil.
- Hypothèses mécanistiques discutées : modulation de neurotransmetteurs du cycle veille-sommeil.
Intérêt du safran dans le TDAH chez l’enfant et l’adolescent
Étude 1 : Crocus sativus L. vs méthylphénidate (Baziar et al., 2019)
Essai en double aveugle, randomisé, chez 54 enfants/adolescents (6–17 ans) avec TDAH (DSM-5), répartis entre un groupe safran et un groupe méthylphénidate (Ritaline).
Protocole :
- Administration de safran ou de méthylphénidate pendant plusieurs semaines.
- Mesures via échelles standardisées d’attention, d’hyperactivité et d’impulsivité.
Résultats rapportés :
- Scores TDAH comparables entre groupes sur les échelles utilisées.
- Tolérance favorable décrite dans le groupe safran.
Étude 2 : Blasco-Fontecilla et al. (2022)
Étude clinique non randomisée chez 63 enfants/adolescents (7–17 ans) recevant pendant 3 mois soit du méthylphénidate (1 mg/kg/j), soit 30 mg de safran.
Protocole :
- Suivi de symptômes TDAH et de fonctions exécutives via échelles dédiées.
- Évaluation du sommeil et d’éventuels effets indésirables.
Résultats rapportés :
- Évolution des symptômes TDAH et des fonctions exécutives dans les deux groupes.
- Tendance plus marquée du safran sur l’hyperactivité ; méthylphénidate davantage associé à l’inattention.
- Durée totale du sommeil accrue dans les deux groupes ; facilité d’endormissement décrite comme plus favorable avec safran.
Sources des études mentionnées
Sources des études mentionnées
Amélioration du bien-être (Jackson et al., 2021)Données sur l’humeur et l’anxiété (Shafiee et al., 2018)Scores de dépression et d’anxiété (Ghaderi et al., 2020)Cas de dépression majeure (Marx et al., 2019)Qualité du sommeil (Lopresti et al., 2021)







